¿Alguna vez te has preguntado de qué estás hecho realmente? Descubre la guía más completa y emocionante sobre el átomo. Viajamos desde la antigua Grecia hasta la física cuántica moderna ¡Entra y sorpréndete!
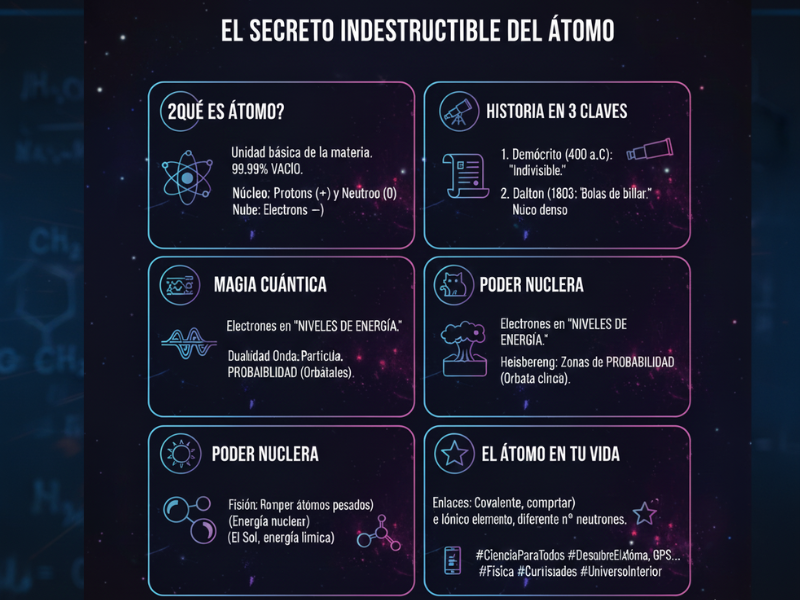
A veces me detengo a mirar mis manos o la taza de café que tengo delante y me explota la cabeza pensando en esto: el 99,99% de todo lo que vemos es, técnicamente, espacio vacío. Sí, como lo lees. Si quitáramos el espacio vacío de todos los átomos de todos los seres humanos del planeta, ¡toda la humanidad cabría dentro de un terrón de azúcar! Pero claro, ese terrón pesaría miles de millones de toneladas.
¿No es increíble? Esa es la energía y la fuerza del átomo. Me apasiona este tema porque entender el átomo es, literalmente, entender las reglas del juego de la realidad. No es solo ciencia, es nuestra biografía más profunda.
- El origen de una idea: De la filosofía a la realidad
- El experimento que lo cambió todo: Rutherford y el núcleo.
- La anatomía de un gigante invisible: ¿De qué está hecho un átomo?
- Las fuerzas fundamentales: El pegamento del universo.
- La Danza Cuántica: De las órbitas de Bohr a la incertidumbre total.
- El DNI de los elementos: ¿Por qué el oro es oro y el oxígeno es oxígeno?
- La Tabla Periódica: El mapa del tesoro de la materia
- Iones: Átomos con chispa
- Energía Atómica: El gigante que dormía en el núcleo
- La Radiactividad: El átomo que se desintegra
- De Átomos a Moléculas: El arte de la conexión
- El Átomo en tu vida diaria (Aunque no lo veas)
- Preguntas Frecuentes (FAQ) sobre el Átomo
- Más allá del núcleo: El zoo de las partículas elementales
- El Átomo y el Universo: Una conexión poética
- ¿Hacia dónde vamos? El futuro de la investigación atómica
- ¿Por qué debería importarte el átomo?
- Resumen para mentes curiosas
El origen de una idea: De la filosofía a la realidad
Todo empezó con un tipo con mucha imaginación llamado Demócrito, allá por la antigua Grecia. Él se preguntó: si corto una manzana a la mitad, y luego otra vez, y otra vez… ¿llegará un punto en que no pueda cortar más? A esa pieza indivisible la llamó átomo, que significa «sin división».
Durante siglos, esta idea fue solo una curiosidad filosófica. Nadie podía verlo, nadie podía probarlo. Pero la curiosidad humana es imparable. Pasamos de pensar que todo era tierra, aire, fuego y agua, a comprender que existen piezas de construcción universales.
La revolución de Dalton: El primer paso serio
Fue John Dalton, ya en el siglo XIX, quien rescató la idea. Él imaginó los átomos como pequeñas bolas de billar, macizas y diferentes para cada elemento. Aunque hoy sabemos que se equivocaba en lo de «macizas», Dalton nos dio la base para entender que la química no es magia, sino proporciones exactas de estas piezas.
El budín de pasas de Thomson y el descubrimiento del electrón
A finales de 1800, las cosas se pusieron interesantes. J.J. Thomson descubrió que el átomo no era indivisible. ¡Tenía algo dentro! Encontró unas partículas diminutas con carga negativa: los electrones. Él se imaginó el átomo como un bizcocho (la carga positiva) lleno de pasas (los electrones).
Fue un gran avance, pero todavía estábamos lejos de la realidad. Faltaba que alguien llegara y «bombardeara» el átomo para ver qué pasaba.
El experimento que lo cambió todo: Rutherford y el núcleo.
Ernest Rutherford hizo algo genial. Lanzó partículas contra una lámina de oro finísima. Esperaba que todas pasaran de largo, pero algunas… ¡rebotaron hacia atrás! Fue como si dispararas una bala contra un pañuelo de papel y la bala volviera hacia ti.
Ahí fue cuando comprendimos que el átomo tiene un corazón pequeño, denso y cargado positivamente: el núcleo.
La anatomía de un gigante invisible: ¿De qué está hecho un átomo?
Vamos a entrar en harina. Si pudiéramos hacer zoom infinito, ¿qué veríamos hoy en día? Olvida las bolas de billar. Un átomo es un sistema dinámico, vibrante y lleno de energía.
1. El Núcleo: El corazón del asunto
En el centro de todo, tenemos el núcleo. Es ridículamente pequeño comparado con el tamaño total del átomo, pero contiene casi toda su masa. Aquí viven dos protagonistas:
- Protones: tienen carga positiva. Son los que dicen «quién es quién». El número de protones define el elemento. Si tienes un protón, eres hidrógeno. Si tienes seis, eres carbono. Es el DNI de la materia.
- Neutrones: son como los mediadores de paz. No tienen carga (son neutros), pero ayudan a que los protones no se repelan entre sí por tener la misma carga. Son el pegamento que da estabilidad.
2. La Corteza o Nube de Electrones
Alrededor del núcleo, en un baile frenético, están los electrones. Tienen carga negativa y casi no pesan nada. Pero no te los imagines como planetas girando alrededor del sol de forma ordenada. La realidad es mucho más loca: están en una especie de «nube de probabilidad».
No sabemos exactamente dónde están en cada momento, solo sabemos dónde es más probable encontrarlos. Esta zona es la que determina cómo se une un átomo con otro. Es la responsable de que el agua sea agua y de que tú puedas tocar la pantalla de tu móvil ahora mismo.
Las fuerzas fundamentales: El pegamento del universo.
¿Por qué el átomo no se desmorona? ¿Por qué los electrones no salen volando? Aquí entran en juego las fuerzas de la naturaleza, y te prometo que es fascinante.
La fuerza nuclear fuerte.
Imagina que intentas juntar dos imanes por el mismo polo. Se repelen, ¿verdad? Pues los protones en el núcleo, al ser todos positivos, deberían salir disparados. Pero no lo hacen gracias a la fuerza nuclear fuerte. Es la fuerza más potente del universo conocido, pero solo actúa en distancias increíblemente cortas. Es el abrazo más fuerte del cosmos.
La fuerza electromagnética.
Esta es la que mantiene a los electrones «atados» al núcleo. Al ser negativos y el núcleo positivo, se atraen. Es un equilibrio perfecto entre las ganas de escapar del electrón y la atracción del centro.
La Danza Cuántica: De las órbitas de Bohr a la incertidumbre total.
Después de que Rutherford descubriera el núcleo, surgió un problema enorme. Según las leyes de la física de aquella época, si un electrón (carga negativa), giraba alrededor de un núcleo (carga positiva), debería perder energía y acabar chocando contra el centro. ¡Toda la materia debería colapsar en un segundo! Pero aquí estamos, vivos y enteros. ¿Qué estaba pasando?
El modelo de Niels Bohr: Los escalones de energía
Aquí entra en escena Niels Bohr en 1913. Él propuso algo que hoy nos parece normal, pero que en su momento fue una revolución: los electrones no pueden estar en cualquier sitio. Se mueven en niveles de energía específicos, como si fueran los peldaños de una escalera.
Si el electrón está en un peldaño, es estable. Para subir de peldaño, necesita un «chute» de energía (como luz o calor). Cuando baja de peldaño, suelta esa energía en forma de un destello de luz llamado fotón. Por eso los fuegos artificiales tienen colores: estamos viendo a los electrones de diferentes átomos saltar de peldaño en peldaño. ¡Es pura coreografía atómica!
Schrödinger y el gato: Bienvenidos a la nube de probabilidad
Pero la ciencia no se detiene. Llegaron tipos como Erwin Schrödinger y Werner Heisenberg y dijeron: «Bohr, tu modelo es bonito, pero la realidad es mucho más caótica».
Descubrieron que el electrón no es solo una partícula, ¡también se comporta como una onda! Olvida las órbitas como las de los planetas. En el modelo actual, hablamos de orbitales. Un orbital no es un camino, sino una zona del espacio donde hay muchísimas posibilidades de encontrar al electrón.
Es como si intentaras localizar a un niño hiperactivo en un parque de juegos: no sabes exactamente dónde está en cada segundo, pero sabes que suele estar cerca de los columpios. Esa «zona de los columpios» es el orbital. Esta es la base de la mecánica cuántica, y aunque parezca una locura, es lo que permite que funcionen los láseres, los transistores de tu ordenador y los aparatos de resonancia magnética de los hospitales.
El DNI de los elementos: ¿Por qué el oro es oro y el oxígeno es oxígeno?
Esta es una de las preguntas que más me fascinaban de pequeña. Si todos los átomos tienen protones, neutrones y electrones… ¿por qué algunos forman un gas que respiramos y otros un metal brillante y caro?
La respuesta es simple y elegante: la cantidad.
El Número Atómico: El alma del elemento
El número de protones en el núcleo es lo que define la identidad de un átomo. Es su número de serie único.
- Si un átomo tiene 1 solo protón, es Hidrógeno. El combustible de las estrellas.
- Si tiene 8, es Oxígeno. Lo que nos mantiene vivos.
- Si tiene 79, es Oro.
Si por algún proceso físico pudieras añadir o quitar protones a un átomo (algo que ocurre en las estrellas o en los reactores nucleares), estarías literalmente transformando la materia. ¡El sueño de los antiguos alquimistas hecho realidad por la física!
La Masa Atómica: El peso de lo invisible
La masa del átomo es básicamente la suma de sus protones y neutrones. Los electrones son tan ligeros que ni los contamos para el peso, como si te pesaras tú y no contaras si llevas un pelo más o menos en la cabeza.
Isótopos: Hermanos con diferente peso
Aquí viene un concepto clave que a veces confunde. Imagina dos átomos de Carbono. Ambos tienen 6 protones (si no, no serían carbono). Pero uno tiene 6 neutrones y el otro tiene 8. Estos «hermanos» se llaman isótopos.
El carbono con 8 neutrones (Carbono-14) es famoso porque es inestable y se desintegra con el tiempo, lo que nos permite a los humanos saber cuántos años tiene un hueso de dinosaurio o una momia antigua. El átomo, además de constructor, ¡es el mejor historiador del mundo!
La Tabla Periódica: El mapa del tesoro de la materia
No puedo hablar del átomo sin mencionar a Dmitri Mendeléyev. Él fue el genio que se dio cuenta de que, si ordenábamos los elementos por su número de protones y por cómo se comportan sus electrones, aparecía un patrón.
La tabla periódica no es solo una lista, es un mapa de relaciones. Los elementos que están en la misma columna se portan igual porque tienen el mismo número de electrones en su capa más externa (la capa de valencia). Esos electrones externos son como las «manos» del átomo: son los que usan para agarrarse a otros átomos.
- Los gases nobles (a la derecha del todo), tienen sus «manos» ocupadas y son muy solitarios, no quieren reaccionar con nadie.
- Los metales alcalinos (a la izquierda, como el sodio), tienen una «mano» libre y están desesperados por agarrarse a alguien, por eso son tan reactivos.
Iones: Átomos con chispa
Normalmente, un átomo es neutro: tiene el mismo número de protones (+) que de electrones (-). Las cargas se cancelan y todo está en paz. Pero a veces, un átomo pierde o gana electrones.
- Si pierde un electrón, se queda con más carga positiva: es un Catión.
- Si gana un electrón, se vuelve negativo: es un Anión.
Estos átomos «eléctricos» se llaman iones, y gracias a ellos tus neuronas pueden enviarse señales ahora mismo, para que entiendas lo que estás leyendo. Sin el movimiento de iones de sodio y potasio en tu cuerpo, simplemente no podrías pensar ni mover un dedo.
Energía Atómica: El gigante que dormía en el núcleo
Si alguna vez has visto la famosa ecuación de Einstein, E = mc^2, aquí es donde cobra vida. Esa fórmula nos dice que una cantidad diminuta de masa puede convertirse en una cantidad monstruosa de energía. Y el lugar donde se guarda ese «tesoro» es, precisamente, el núcleo del átomo.
Existen dos formas principales de liberar ese poder, y son procesos totalmente opuestos: la fisión y la fusión.
1. Fisión Nuclear: Romper para liberar
La fisión es lo que ocurre en las centrales nucleares actuales. Imagina un núcleo muy grande y pesado, como el del Uranio-235. Es un núcleo inestable, está «incómodo». Si lo golpeamos con un neutrón, se parte en dos.
Al romperse, no solo se liberan fragmentos más pequeños, sino que se suelta una cantidad de calor impresionante y más neutrones que irán a golpear a otros átomos cercanos. Esto es lo que llamamos una reacción en cadena. Si la controlamos (como en una central), tenemos electricidad para millones de hogares sin emitir CO2. Si no se controla… bueno, ya sabemos lo que ocurre en una bomba atómica.
2. Fusión Nuclear: Unir para brillar
Esta es mi favorita porque es, literalmente, lo que hace que el Sol brille. En lugar de romper átomos grandes, juntamos átomos muy pequeños (como el Hidrógeno), para formar uno más grande (Helio).
Para que esto pase, se necesita una presión y una temperatura brutales, porque los núcleos no quieren estar juntos (recuerda que los protones se repelen). Pero cuando lo logran, la energía que liberan es mucho mayor que la de la fisión y, además, ¡no deja residuos radiactivos peligrosos! Estamos intentando replicar esto en la Tierra con proyectos como el ITER, si lo logramos, tendremos energía limpia e infinita para siempre. ¡Crucemos los dedos!
La Radiactividad: El átomo que se desintegra
Seguro que has oído la palabra «radiactivo» y te ha entrado un poco de respeto. Es normal. Pero la radiactividad es un fenómeno natural. Hay átomos que son «ansiosos» por naturaleza; su núcleo tiene un equilibrio precario entre protones y neutrones.
Para alcanzar la estabilidad, estos átomos emiten partículas o energía. Es lo que llamamos desintegración radiactiva.
- Partículas Alfa: son núcleos de helio, pesadas y lentas. Una hoja de papel las detiene.
- Partículas Beta: electrones rápidos. Necesitas una lámina de aluminio para frenarlas.
- Rayos Gamma: es energía pura, como la luz pero muchísimo más potente. Pueden atravesar casi cualquier cosa, excepto bloques gruesos de plomo o cemento.
Lo curioso es que tú eres un poco radiactivo. Sí, tienes Carbono-14 y Potasio-40 en tu cuerpo. ¡Estamos integrados en este baile de energía cósmica!
De Átomos a Moléculas: El arte de la conexión
Un átomo solo es como una pieza de LEGO solitaria en el suelo. Es interesante, pero no sirve para mucho. La verdadera magia ocurre cuando los átomos deciden unirse para formar moléculas.
¿Cómo lo hacen? Todo se resume en los electrones de su capa exterior. Los átomos quieren ser estables, y para la mayoría, la estabilidad significa tener 8 electrones en su última capa (la famosa Regla del Octeto).
El Enlace Covalente: Compartir es vivir
Imagina dos átomos de Hidrógeno. Cada uno tiene un electrón, pero quieren dos para estar tranquilos. ¿Qué hacen? Se acercan tanto que comparten sus electrones. Ese «pegamento» electrónico es un enlace covalente. Es el enlace que forma el agua (H_2O), o el oxígeno que respiras (O_2).
El Enlace Iónico: El robo necesario
A veces, un átomo es mucho más fuerte que otro. El Cloro, por ejemplo, es un «ladrón» de electrones, y al Sodio no le importa «regalar» el único que le sobra. Cuando el Sodio le da su electrón al Cloro, uno se vuelve positivo y el otro negativo. Como los opuestos se atraen, se quedan pegados con una fuerza increíble. ¿El resultado? La sal de mesa que le pones a tus patatas fritas.
El Átomo en tu vida diaria (Aunque no lo veas)
A estas alturas, quizá pienses: «Vale, esto es muy teórico». Pero déjame decirte que el átomo es el protagonista de tu rutina:
- Tu smartphone: Los chips funcionan gracias al movimiento de electrones en materiales semiconductores como el Silicio. Sin física atómica, estarías usando señales de humo.
- La medicina: Cuando te hacen una radiografía o un PET para detectar una enfermedad, estamos usando la radiactividad de los átomos para «mirar» dentro de ti sin abrirte.
- La luz LED: Esos diodos que iluminan tu casa funcionan haciendo que los electrones salten entre diferentes niveles de energía en un material semiconductor, liberando fotones de luz.
Preguntas Frecuentes (FAQ) sobre el Átomo
¿Se puede ver un átomo?
No con luz visible (como la de nuestros ojos), porque los átomos son más pequeños que la longitud de onda de la luz. Pero tenemos microscopios de efecto túnel que pueden «sentirlos» y crear mapas de su superficie. ¡Ya tenemos fotos de grupos de átomos!
¿Es peligroso el átomo?
El átomo en sí no es malo. Es como un martillo: sirve para construir una casa o para hacer daño. La ciencia nos da la herramienta, nosotros decidimos cómo usarla.
¿De qué color es un átomo?
No tienen color. El color es una propiedad de cómo la luz rebota en grandes grupos de átomos. Un átomo individual es demasiado pequeño para tener «color».
¿Son eternos los átomos?
Casi. Algunos isótopos se desintegran rápido, pero los átomos estables de tu cuerpo podrían haber estado antes en una estrella que explotó hace miles de millones de años. Somos, literalmente, polvo de estrellas.
¿Sabías que el 90% de los átomos de tu cuerpo se renuevan cada año? No somos la «materia» de la que estamos hechos, sino el «patrón» en el que esos átomos se organizan.
Más allá del núcleo: El zoo de las partículas elementales
Durante mucho tiempo, pensamos que los protones y los neutrones eran bolitas sólidas. Pero en la década de los 60, los científicos empezaron a sospechar que había algo más. Gracias a los aceleradores de partículas (esos túneles gigantes donde hacemos chocar átomos a casi la velocidad de la luz), descubrimos que el núcleo es mucho más complejo.
Los Quarks: Los ladrillos definitivos
Los protones y los neutrones están hechos de unas partículas aún más pequeñas llamadas quarks. Hay seis tipos (o «sabores», como dicen los físicos con mucho humor), pero los que nos importan para la materia normal son el Up (arriba) y el Down (abajo).
- Un Protón tiene dos quarks Up y uno Down.
- Un Neutrón tiene dos quarks Down y uno Up.
Lo más loco es que nunca verás un quark solo. Están unidos por la fuerza nuclear fuerte a través de otras partículas llamadas gluones (del inglés glue, pegamento). Es una unión tan brutal que, si intentas separar dos quarks, la energía que usas para estirarlos se convierte automáticamente en… ¡más quarks! Es como intentar romper una goma elástica y que, al romperse, aparezcan dos gomas nuevas en tus manos.
El Bosón de Higgs: ¿Por qué pesamos algo?
Si el átomo es mayormente vacío, ¿por qué las cosas tienen masa? ¿Por qué te cuesta empujar un coche pero no una pluma? En 2012 confirmamos la existencia del Bosón de Higgs, a menudo llamado «la partícula de Dios» (aunque a los científicos no les hace mucha gracia el nombre).
Imagina que el universo está lleno de una especie de «melaza» invisible llamada Campo de Higgs. Algunas partículas pasan por ella sin esfuerzo y no tienen masa (como los fotones de la luz). Otras se quedan «pegadas» y les cuesta moverse, esas son las que adquieren masa. Sin el Higgs, los átomos no podrían formarse porque los electrones saldrían disparados a la velocidad de la luz. ¡No existiríamos!
El Átomo y el Universo: Una conexión poética
Llegados a este punto, me pongo un poco sentimental. Cada átomo de Hierro en tu sangre, cada átomo de Calcio en tus dientes y cada átomo de Oxígeno que llena tus pulmones no se creó aquí en la Tierra.
Se forjaron en el corazón de estrellas masivas hace miles de millones de años. Cuando esas estrellas agotaron su combustible y explotaron en forma de supernovas, sembraron el cosmos con los elementos que hoy te forman a ti. Como decía Carl Sagan, somos polvo de estrellas que ha llegado a un nivel de complejidad tal, que ahora puede preguntarse por su propio origen.
Entender el átomo no es solo estudiar química; es hacer arqueología cósmica. Es entender que estamos conectados con el inicio del tiempo y con los confines del espacio.
¿Hacia dónde vamos? El futuro de la investigación atómica
La ciencia no se detiene. Ahora mismo, miles de mentes brillantes están intentando descifrar enigmas que todavía nos quitan el sueño:
- Materia Oscura:sabemos que hay algo ahí fuera que mantiene unidas a las galaxias, pero no está hecho de los átomos que conocemos. ¿Qué es?
- Computación Cuántica: estamos aprendiendo a usar las extrañas leyes de los electrones para crear ordenadores millones de veces más rápidos que los actuales.
- Antimateria: sabemos que por cada partícula de materia existe una de antimateria. Si se tocan, se aniquilan liberando energía pura. ¿Por qué el universo está lleno de materia y casi no hay antimateria?
¿Por qué debería importarte el átomo?
A ver, seamos sinceros: puedes vivir perfectamente sin saber qué es un quark o cuántos electrones tiene el oro. Pero cuando conoces el átomo, el mundo deja de ser una colección de «cosas» y se convierte en un espectáculo de fuerzas, energía y equilibrio.
Mirar una flor, el mar o los ojos de alguien que quieres ya no es lo mismo. Sabes que debajo de esa apariencia hay una danza frenética de billones de partículas que se atraen y se repelen, que comparten energía y que llevan ahí desde que el universo era apenas un suspiro.
Resumen para mentes curiosas
Por si te has perdido en algún punto de este mega-post, aquí tienes los puntos clave:
- El átomo es la unidad básica de la materia, pero es 99,99% vacío.
- Tiene un núcleo central (protones y neutrones) y una nube exterior (electrones).
- Lo que define a un elemento es su número de protones.
- La física cuántica nos dice que no podemos saber exactamente dónde están los electrones, solo su probabilidad.
- Toda la energía que mueve el mundo (y el sol) viene de manipular el núcleo (fisión y fusión).
- Estamos hechos de átomos forjados en estrellas muertas.
¿Cuál es la parte que más te ha sorprendido? ¿Sabías lo del espacio vacío o lo de los quarks? La ciencia es una conversación constante, y este blog no sería nada sin tu opinión.
Déjame un comentario aquí abajo con tu duda más loca o, simplemente, dime qué otro tema te gustaría que exploráramos así, a fondo y sin filtros. ¡Prometo leerte y responderte!
Si te ha gustado, comparte esta entrada con ese amigo al que le gusta cuestionarlo todo. ¡Hagamos que la curiosidad se vuelva viral!